
Produkta ievads
| Litija fluorīds Pamatinformācija |
| Apraksts Izmanto atsauces |
| Produkta nosaukums: | Litija fluorīds |
| Sinonīmi: | um 99,99% Litija fluorīds; LITIJA FLUORIDELITIJA FLUORIDELITIJA FLUORIDELITIJA FLUORIDS; Fluorolitijs; Litija fluorīds (Li3F3); Litija fluorīds (LiF); Litija fluors; Litija monofluorīds |
| CAS: | 7789-24-4 |
| MF: | FLi |
| MW: | 25.94 |
| EINECS: | 232-152-0 |
| Produktu kategorijas: | Litija sāļi; Materiālzinātne; Neorganiskie materiāli; olu materiāli; metālu halogenīds; Metālu un keramikas zinātne; LITIJA SAVIENOJUMI; Kristālu neorganiskie savienojumi; Katalīze un neorganiskā ķīmija; Ķīmiskā sintēze; Elektrodu materiāli Sintētiskie reaģenti; Neorganiskie elektroniskie sāļi un organiskās šķiedras elektroniskie sāļi; Litija sāļi; Metāla un keramikas zinātne; Sāļi; Litija Metāla un keramikas zinātne |
| Mol fails: | 7789-24-4.mol |
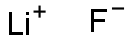 |
|
| Litija fluorīda ķīmiskās īpašības |
| Kušanas punkts | 845 grādi (lit.) |
| Vārīšanās temperatūra | 1681 grāds |
| blīvums | 2,64 g/ml 25 grādos (lit.) |
| tvaika spiediens | 0Pa 25 grādos |
| refrakcijas indekss | 1.3915 |
| Fp | 1680 grādi |
| uzglabāšanas temp. | Uzglabāt no +5 grāda līdz +30 grādam. |
| šķīdība | Šķīst 0,29 g/100 ml (20 grādi) un fluorūdeņradi. Nešķīst spirtā. |
| formā | nejauši kristāli |
| krāsa | Balts līdz gandrīz balts |
| Īpatnējais smagums | 2.635 |
| PH | 6.0-8.5 (25 grādi, 0.01 M H2O) |
| Šķīdība ūdenī | 0,29 g/100 ml (20 ºC) |
| Jūtīgs | Higroskopisks |
| λmaks | λ: 260 nm Maksimālais: mazāks vai vienāds ar 0,01 λ: 280 nm Maksimālais: mazāks vai vienāds ar 0,01 |
| Merck | 14,5531 |
| Šķīdības produkta konstante (Ksp) | pKsp: 2,74 |
| Ekspozīcijas robežas | ACGIH: TWA 2,5 mg/m3 NIOSH: IDLH 250 mg/m3; TWA 2,5 mg/m3 |
| Stabilitāte: | Stabils, bet higroskopisks. Hidrolizējas ūdens klātbūtnē, veidojot fluorūdeņražskābi, kas uzbrūk stiklam – neglabājiet stikla pudelēs. Nesaderīgs ar ūdens šķīdumiem, stiprām skābēm, spēcīgiem oksidētājiem. |
| InChIKey | PQXKHYXIUOZZFA-UHFFFAOYSA-M |
| LogP | 0.23 pie 25 grādiem |
| CAS datu bāzes atsauce | 7789-24-4(CAS datu bāzes atsauce) |
| NIST ķīmijas atsauce | Litija fluorīds (7789-24-4) |
| EPA vielu reģistra sistēma | Litija fluorīds (7789-24-4) |
| Drošības informācija |
| Bīstamības kodi | T |
| Riska paziņojumi | 25-32-36/37/38-23/24/25 |
| Drošības paziņojumi | 22-26-36/37/39-45 |
| RIDADR | ANO 3288 6.1/PG 3 |
| WGK Vācija | 2 |
| RTECS | OJ6125000 |
| F | 10-21 |
| Bīstamības piezīme | Toksisks |
| TSCA | Jā |
| Bīstamības klase | 6.1 |
| Iepakojuma grupa | III |
| HS kods | 28261900 |
| Dati par bīstamām vielām | 7789-24-4(Dati par bīstamām vielām) |
| Toksiskums | LD jūrascūciņām (mg/kg): 200 iekšķīgi, 2000 sc (Waldbott) |
| MSDS informācija |
| Pakalpojumu sniedzējs | Valoda |
|---|---|
| Litija fluorīds | angļu valoda |
| SigmaAldrihs | angļu valoda |
| ACROS | angļu valoda |
| ALFA | angļu valoda |
| Litija fluorīda lietošana un sintēze |
| Apraksts | Litija fluorīdam (LiF) ir zemākais refrakcijas indekss no visiem izplatītajiem infrasarkanajiem materiāliem. Tam ir visaugstākā UV caurlaidība no jebkura materiāla, kas spēj ievērojami pārraidīt VUV apgabalu pie ūdeņraža Laimana-alfa līnijas (121 nm). Litija fluorīdu var izmantot uzlādējamās litija akumulatoros, radiācijas dozimetros personāla uzraudzībai, kā arī radiācijas izpētei, kā optisku materiālu, kā siltuma izlietnes materiālu, keramikas ražošanā un šķidrās degvielas šķīdināšanai izkausētā sāls reaktoros. litija fluorīda kristāls |
| Lietojumi | Litija fluorīds (LiF) ir ūdenī nešķīstošs litija avots izmantošanai pret skābekli jutīgos lietojumos, piemēram, metālu ražošanā. To visplašāk izmanto kā plūsmu keramikas, piemēram, emalju, glāžu un glazūru ražošanā. Līdzīgi to izmanto arī cietlodēšanai un metināšanas kušņos un kausētā sāls ķīmijā metalurģijā. Litija fluorīdu izmanto arī: Rentgenstaru monohromatora plāksnes kā analīzes kristāls: litija fluorīds tiek izmantots arī rentgena monohromatora plāksnēm, kur tā režģa atstatums padara to par visnoderīgāko analīzes kristālu. Siltuma izlietnes materiāli UV caurlaidības logi: Litija fluorīds ir materiāls ar ekstrēmāko UV caurlaidību, un to izmanto īpašai UV optikai. Litija fluorīds labi nokļūst VUV reģionā pie ūdeņraža Laimana-alfa līnijas (121 nm) un tālāk. |
| Atsauces | [1] H. Li, G. Rihters, J. Maiers, LiF klasteru atgriezeniskā veidošanās un sadalīšanās, izmantojot pārejas metālu fluorīdus kā prekursorus un to pielietojums atkārtoti uzlādējamās litija baterijās, Advanced Materials, 2003, sēj. 15, 736-739 [2] JR Cameron, F. Daniels, N. Johnson, G. Kenney, Radiation Dosimeter Utilising the Thermoluminescence of Lithium Fluoride, Science, 1961, sēj. 134, 333-334 [3] ET Kvamme, JC Earthman, DB Leviton, BJ Frey, Litija fluorīda materiāla īpašības, kas lietotas NIRCam instrumentā, Proc. SPIE 59,4, 2005 [4] Y. Kogure, H. Kaburaki, Y. Hiki, Low-Temperature Thermal Properties of Lithium Fluoride Containing Containing Dislocations, Fonon Scattering in Condensed Matter, 1979, 267-270 [5] H. Naghib-zadeh, C. Glizky, I. D?rfel, T. Rabe, Bārija titanāta keramikas zemas temperatūras saķepināšana, pievienojot litija fluorīdu saturošas saķepināšanas piedevas, Journal of the European Ceramic Society, 2010. sēj. 30, 81-86 [6] MW Rosenthal, PR Kasten, RB Briggs, Molten-Salt Reactors – History, Status, and Potential, 1970, sēj. 8, 107-117 |
| Apraksts | litija fluorīds spēcīgi kairina acis un ādu; kālija bromīds ir toksisks, norijot un ieelpojot; nātrija hlorīds ir galda sāls, kas ir medicīniska problēma, ja to uzņem pārmērīgā daudzumā, taču tas noteikti nerada būtisku apdraudējumu neatliekamās palīdzības sniedzējiem. |
| Ķīmiskās īpašības | Litija fluorīds ir balta kristāliska cieta viela. Tas nav higroskopisks, tāpat kā citi litija halogenīdi, un to neietekmē gaisa iedarbība. Litija fluorīds ir vismazāk šķīstošs no sārmu metālu fluorīdiem. Šī īpašība to salīdzina ar sārmzemju fluorīdiem. Litija fluorīds atšķiras no citiem litija halogenīdiem ar to, ka tas neveido hidrātus, kurus var izolēt no šķīduma. Litija fluorīda šķīdība palielinās, jo ūdens šķīdumam pievieno fluorūdeņražskābi. Šādos apstākļos fluorīda jons tiek pārveidots par bifluorīda jonu HF-2, ļaujot tālāk izšķīst cietajam litija fluorīdam. |
| Fizikālās īpašības | Balti kubiskie kristāli; refrakcijas indekss 1,3915; blīvums 2,635 g/cm3; kūst 845 grādos; iztvaiko 1676 grādos; ļoti vāji šķīst ūdenī 0,27 g/100g pie 18 grādiem; šķīst fluorūdeņražskābē; nešķīst spirtā. |
| Lietojumi | Litija fluorīdu galvenokārt izmanto kā plūsmu glāzēs, stiklveida emaljās un glazūrās; alumīnija lodēšanā un metināšanā; un tā prizmas infrasarkanajos spektrofotometros. Savienojumu izmanto arī saules enerģijas uzglabāšanai. |
| Lietojumi | Kā plūsma alumīnija lodēšanai un metināšanai stiklveida emalju un glazūru ražošanā. Litija fluorīda prizmas tiek izmantotas infrasarkanajos spektrofotometros. |
| Lietojumi | Litija fluorīds tiek plaši izmantots daudzās jomās. To izmanto stikla oderējuma lodēšanas procesā kā līdzšķīdinātāju. To var izmantot kā alumīnija elektrolīzes un retzemju elektrolīzes piedevu kā kristālu rentgenstaru spektrometrijā. To izmanto arī specializētā UV optikā, jo tā ir liela joslas sprauga un caurspīdīgums pret īsa viļņa garuma ultravioleto starojumu. Tas ir iesaistīts, lai reģistrētu gamma staru, beta daļiņu un neitronu jonizējošā starojuma iedarbību termoluminiscējošos dozimetros. Kodolreaktoros litija fluorīdu sajauc ar berilija fluorīdu, veidojot bāzes šķīdinātāju, ko izmanto izkausētā sāls reaktora eksperimentā (MSRE). Turklāt tas ir noderīgs kā savienojuma slānis, lai uzlabotu elektronu iesmidzināšanu polimēru gaismas diodēs (PLED) un organiskās gaismas diodēs (OLED). |
| Sagatavošana | Litija fluorīdu iegūst, apstrādājot litija hidroksīda vai litija karbonāta ūdens šķīdumu ar fluorūdeņražskābes ūdens šķīdumu: LiOH + HF → LiF + H2O. |
| Uzliesmojamība un sprādzienbīstamība | Nedegošs |
| Drošības profils | Saindēšanās norijot un subkutāni. Karsējot līdz sadalīšanai, tas izdala toksiskus F- izgarojumus. Izmanto kā plūsmu emaljās, glāzēs, glazūrās un metināšanā. Skatiet arī FLUORĪDI un LITIJA SAVIENOJUMI. |
| Attīrīšanas metodes | Iespējamie piemaisījumi ir LiCO3, H2O un HF. Tos var noņemt, kalcinējot to sarkanā karstumā, pēc tam pulverizējot ar Pt piestu un uzglabājot parafīna pudelē. Tā šķīdība H2O ir 0,27% 18o temperatūrā. Tas izgaro starp 1100-1200o. [Kwasnik in Handbook of Preparative Inorganic Chemistry (Red. Brauer) Academic Press Vol I p 235 1963]. |
| Struktūra un uzbūve | LiF kosmiskais režģis pieder pie kubiskās sistēmas, un tā akmeņsāls struktūras režģa konstante ir a=0,40173 nm un Li-F=0.201 nm. Šķelšanās plakne ir (100). |
| Litija fluorīda sagatavošanas produkti un izejvielas |
| Izejvielas | Hydrogen fluoride-->Litija karbonāts |
Populāri tagi: litija fluorīds, Ķīnas litija fluorīda ražotāji, piegādātāji, rūpnīca
Jums varētu patikt arī
-

Labākās cenas nozares kvalitātes CAS 7757-83-7 nātrija sulfīts
-

Augstas tīrības pakāpes CAS 14075-53-7 kālija tetrafluorborāts
-

SD-160
-

Cikloheksanols, 4,4-(1-metiletilidēn)bis-, polimērs ar (hlormetil)oksirānu
-

Rūpnīcas piegādātājs augstas tīrības pakāpes cikloheksānkarbonskābe CAS 98-89-5
-

2,3-Lutidīns
Nosūtīt pieprasījumu

